前沿合作 再登顶刊丨Nature Cancer揭示RIOK1相分离机制,破解肝癌耐药难题
导读
在肝癌(HCC)这一全球高发的恶性肿瘤领域,科学家们始终在不懈探索新的治疗策略和靶点。近期,中国科学技术大学附属第一医院(安徽省立医院)刘连新教授团队,在癌症研究领域顶级期刊《Nature Cancer》(IF 23.5)上发表了题为“RIOK1 phase separation restricts PTEN translation via stress granules activating tumor growth in hepatocellular carcinoma”的研究论文,为肝癌治疗领域带来了新突破。该研究揭示了RIOK1蛋白在肝癌应激适应性调控的关键作用,并通过液-液相分离(LLPS)机制揭示了其促进肝癌进展及靶向药物耐药的具体机制,同时发现了一种潜在增敏肝癌治疗的组合策略,为肝癌患者带来了新的治疗希望[1]。其中,岛津成像质谱显微镜iMScope QT在模拟肝肿瘤内低谷氨酰胺的应激微环境中提供了有力的空间代谢组学数据支持。

图1.文章封面
关键发现
RIOK1蛋白的新角色
刘教授团队发现RIOK1蛋白在肝癌组织中高度表达,并与肝癌的进展和患者的不良预后紧密相关。这一发现为肝癌治疗提供了新的靶点思路。
液-液相分离(LLPS)机制的深入解析
研究团队通过一系列生化实验,揭示了RIOK1如何通过LLPS机制与IGF2BP1和G3BP1蛋白相互作用,促进应激颗粒(SGs)组装,从而劫持并抑制PTEN mRNA的翻译,减少PTEN蛋白的表达,进而促进肝癌细胞的恶性增殖和侵袭。
新型抗癌药物的发现
基于RIOK1在肝癌进展中的关键作用,研究团队筛选并鉴定了一种名为西达本胺(chidamide)的上市药物能够有效下调RIOK1的表达,并显著增强酪氨酸激酶抑制剂(TKIs)的抗癌效果,为肝癌患者提供了新的治疗选择。
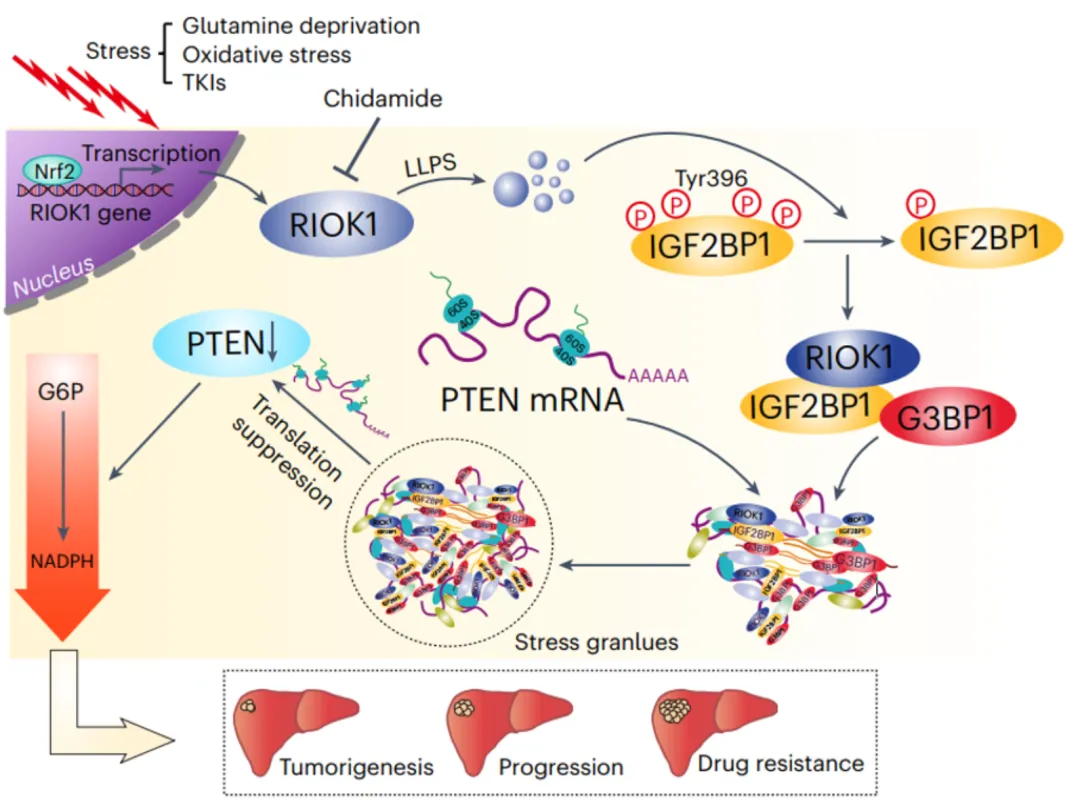
图2.肝癌研究机制模式图
什么是液-液相分离(LLPS)?
液-液相分离(Liquid-Liquid Phase Separation, LLPS)是生物学中一种分子自发聚集形成与周围液相性质不同的液滴或区域的现象。这些液滴在宏观上保持液态,但微观上却呈现出与周围液相不同的分子组成和排列方式。它与无膜细胞器的形成有关,对细胞内生物功能的执行至关重要。举个日常的例子,液-液相分离就像厨房里的油水分离,但发生在细胞内部。细胞内的分子(如蛋白质和核酸)在特定条件下会相互吸引,聚集成小液滴。这些液滴就像细胞内的“小油滴”,各自执行着不同的生物任务,如储存、转运分子或参与信号传导等。LLPS就是这些液滴在细胞内自然形成的过程。
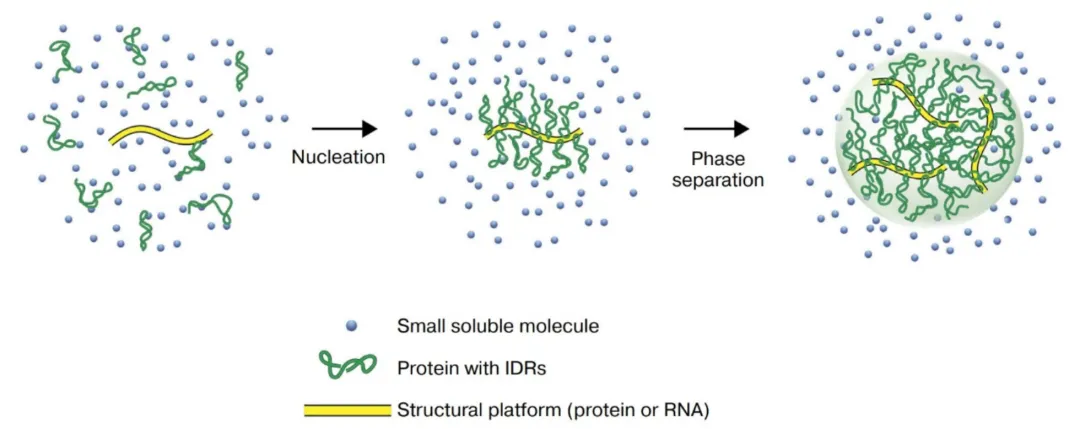
图3.细胞核中的液-液相分离 (LLPS)[2]
含有IDRs(内在无序区域)的蛋白质与一个共同的结构平台相互作用,该平台可以是蛋白质或RNA。无序结构域之间的进一步相互作用导致“蛋白液滴”的形成。
成像质谱技术模拟肝肿瘤内
低谷氨酰胺微环境的可视化研究
研究采用岛津iMScope QT成像质谱技术,对人和小鼠样本的肝癌及邻近正常组织进行快速冷冻和切片处理(厚度约15 μm),借助岛津iMLayer基质升华仪自动完成4-氯-α-氰基肉桂酸(CHCA)基质的升华涂敷,确保基质结晶层均匀分布;利用iMScope QT成像质谱搭载的MALDI离子源,以微米级步长逐点扫描组织切片,结合飞行时间(TOF)质量分析器采集各点的质谱指纹图谱,最终通过数据重构生成肝癌及癌旁区域目标分子的空间分布成像图。实验流程如图4所示。
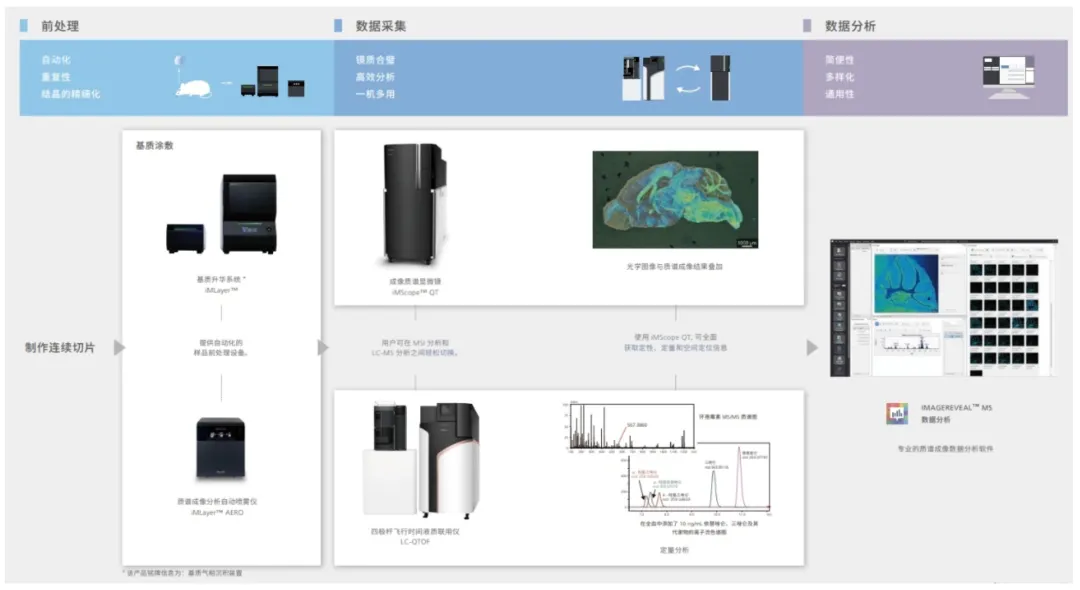
图4.质谱成像流程图
随后利用成像数据处理软件 IMAGEREVEAL MS 对图谱进行分析。结果显示,在人和小鼠样本中,谷氨酰胺在肝脏肿瘤的癌旁区域显著富集(如图5所示),而在肿瘤区域本身并未观察到明显的谷氨酰胺富集。通过可视化技术进一步证实,RIOK1蛋白高表达的肿瘤组织中,谷氨酰胺代谢通路发生了显著改变,从而揭示了 RIOK1 在肿瘤微环境中对应激条件的响应机制及其潜在作用。
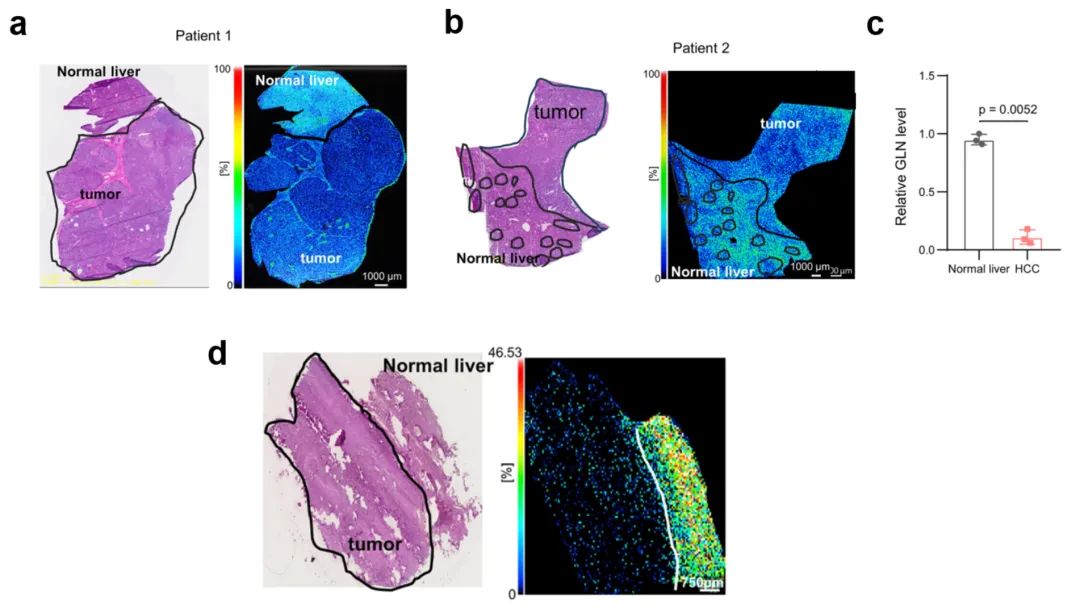
图5.人(a~c)和小鼠样本(d)肿瘤与正常肝组织边界处的质谱成像
黑圈代表肝肿瘤组织
结语
岛津成像质谱显微镜iMScope QT在此次研究中为揭示RIOK1蛋白在肝癌中的作用机制提供了强有力的证据。该研究不仅深化了我们对肝癌发病机制的理解,还为开发新型治疗策略提供了重要依据。随着研究的深入和临床转化的推进,我们期待这些新发现能够尽快转化为实际的临床应用,为更多肝癌患者带来福音!
参考文献
[1] Meng, F., Li, H., Huang, Y. et al. RIOK1 phase separation restricts PTEN translation via stress granules activating tumor growth in hepatocellular carcinoma. Nat Cancer (2025). https://doi.org/10.1038/s43018-025-00984-5
[2]Razin, S., Gavrilov, A (2020). The Role of Liquid–Liquid Phase Separation in the Compartmentalization of Cell Nucleus and Spatial Genome Organization. Biochemistry Moscow, 85, 643–650.
https://doi.org/10.1134/S0006297920060012

