新药研究前沿丨siRNA药物-改变疾病的治疗方式
2020年伊始,新冠病毒席卷全球,“战疫”成为关键词。为早日找到能有效治疗新冠肺炎药物,各大制药公司通过不同的技术全力以赴进行科学难题攻关,开启了一场科研与病毒的赛跑。
新型冠状病毒疫苗的开发是被寄予厚望的控制疫情的办法,例如最近研发进展较为领先的mRNA疫苗。在新冠疫苗的研究中,采用新型核酸疫苗技术的占大多数,因为较传统疫苗,新型核酸疫苗在生产工艺、生产速度、研发、保存、运输成本等方面具有一定优势,同时其有效性和安全性更有保障。
此外,最近核酸药物领域发生了一系列的标志性事件:
2020年4月3日
瑞博生物宣布获得4.7亿元人民币的C2轮融资支持。
2020年4月14日
Alnylam公司获得黑石集团20亿美元的投资来支持其RNAi疗法vutrisiran和ALN-AGT等在研药物的开发。
2020年4月16日
Moderna与美国生物医学高级研究与开发局(BARDA)达成协议,获得最高4.83亿美元的资金支持,用于支持测试和生产mRNA-1273疫苗。
这一系列里程碑式事件,让核酸药再次走上“星光大道”,获得资本圈的关注。
本文将在综述性文章《Therapeutic siRNA: state of the art》的基础上,对核酸药发展趋势以及siRNA药物研发中的关键技术修饰与递送进行介绍,希望有助于加深大家对核酸药物领域的认识。
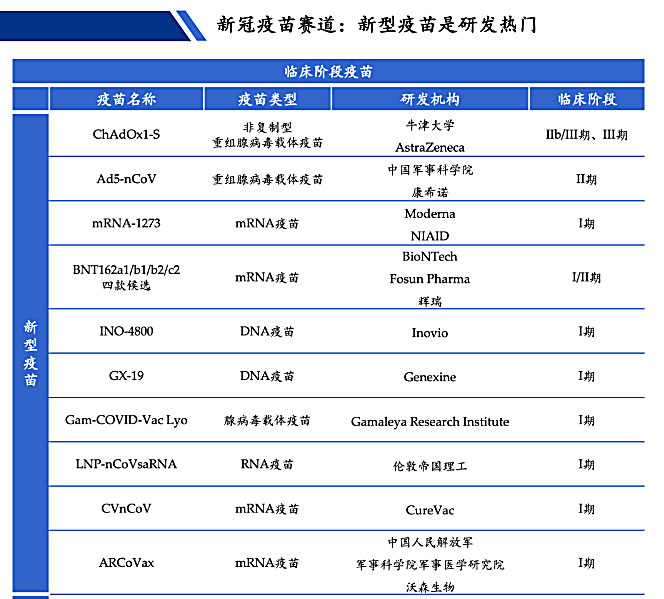
图片来源:WHO,浩悦资本
基因治疗特异性地靶向致病基因,使得治疗更加精准和个性化。目前,干扰小核酸(siRNA)、反义核酸(ASO)和基因编辑(比如CRISPR技术)等被用于纠正目标基因的表达。干扰核酸药物治病机理是长链双链RNA被剪切成小核酸(siRNA)后,与蛋白结合形成干扰复合体(RISC),复合体RISC靶向目标基因(如信使RNA),使其降解,敲出该基因的下游蛋白表达,起到疾病治疗作用。
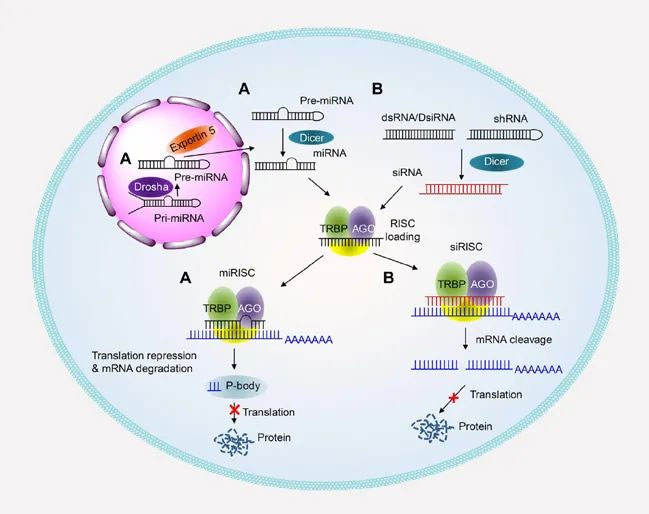
图1 干扰小核酸的作用机理
2001年
2001年,Tuschl等人使用化学合成的小核酸,在哺乳动物细胞内成功地沉默了目标基因的表达。但是此后,核酸药物的开发并不是一帆风顺的。早期,干扰小核酸存在很多问题:比如稳定性差、特异性差和需要特殊的递送技术等,加上短时间内无法解决这些问题,导致了大量资本和众多制药公司如罗氏、默克、辉瑞等退出了该领域。
2016-2017年
2016年,科学家们针对以上问题找到了很好的解决方案,特别是核酸单体的化学修饰和递送技术取得突破性的进展,使得该领域取得到飞跃式的发展。2016年底,FDA批准了Biogen/Ionis治疗脊髓性肌萎缩症(SMA)的反义核苷酸Nusinersen,并在2017年取得了8.8亿美元的销售。
2018年
2018年,美国FDA批准了第一个小核酸干扰的药物Patisiran,用于治疗遗传性转甲状腺素蛋白淀粉样变性(hATTR amyloidosis)。
2019年
2019年,FDA批准了Givosiran用于治疗肝卟啉症(AHP)。其中,Patisiran是全球第一个siRNA的小核酸药物。截至目前,还有超过6款小核酸药物获批上市,如Fomivirsen(Ionis, 1998)、Macugen(Eyetech/Pfizer, 2004)、Kynamro(赛诺菲,2013)等。
干扰小核酸起作用的方式依靠Watson-Crick碱基配对,而小分子药物和抗体药物需要特异性的识别和结合在蛋白上,因此小核酸药物相对于小分子药物和抗体药物具有一些先天的优势,有望实现传统方式(小分子或抗体药)无法治疗疾病的治疗。设计的小核酸只要能与致病基因序列进样碱基配对,就有可能起到治疗作用。所以,开发小核酸药物需要的周期相对较短,并且有望用于传统方式难以治疗的疾病。
尽管小核酸具有广阔的应用前景,尤其是在未被满足的疾病领域,由于它们都是带有负电荷的大分子,不具备穿透组织或者细胞膜的能力,因此,细胞内外的物理屏障限制其使用。未经过修饰的小核酸具有很多缺点,比如:
(1)在人体血液循环系统中,小核酸中的磷酸酯键对酶不稳定(RNase和Phosphatase),一旦进入体循环,内源性或外源性的核酸酶很快就能降解小核酸,从而阻止药物到达预定的组织。
(2)潜在的脱靶效应,如siRNA的正义链能介导同源基因的表达沉默,引起由正义链介导的脱靶效应。另外,理论上,小核酸只有在反义链和目标信使RNA完全配对才会起到治疗作用。然而,序列上小部分的不匹配也可能导致其它的基因沉默,造成脱靶效应,产生毒副作用。
在过去几年,为了实现良好的治疗效果、减低或避免毒副作用,药物化学家们在核酸修饰和递送系统等方面取得了重大突破。这些化学修饰和递送系统提高了治疗效果、选择性和安全性。开发的递送材料包括脂质体、共价结合配体、多肽、无机纳米粒子等。下面简要地介绍核酸修饰和递送系统。
01 糖的化学修饰
在核酸药物开发早期,很多核酸化合物在体外展现出很好的生物活性,但是体内活性大大降低或者完全丧失。其主要原因是未修饰的核酸在体内很容易被酶或其他内源性物质分解。化学修饰主要包括糖的2位羟基(2’OH)修饰成甲氧基(2’OMe),氟(F)或者(2’MOE);或者将一些核酸单元换成LNA、UNA或者GNA(见图2)。这些修饰能成功地增加活性及选择性和降低脱靶效应,减少副作用。
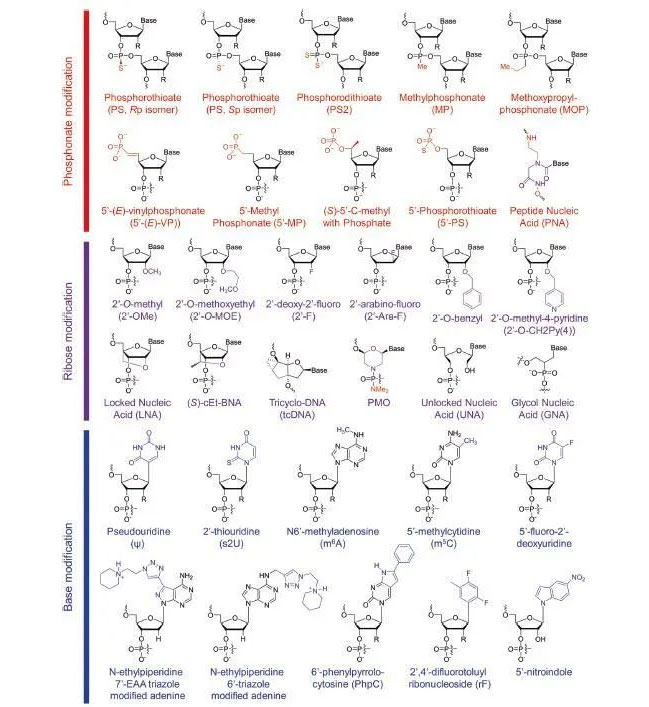
图2 核酸药物相关修饰
02 磷酸酯的修饰
在反义核酸(ASO)中,常常将磷酸酯键(PO)换成硫代磷酸酯(PS)。这种修饰通常会增加核酸对核酸酶的稳定性,尽管PS可能会降低核酸和靶基因的亲和力,但是PS修饰更加疏水和稳定,所以在干扰小核酸和反义核酸中仍然是一种重要的修饰。通常在实际应用中,控制PS单元的数量可以平衡副作用带来的影响。PS单元有2个构型Rp和Sp。在ASO中,Wave Life发现PS的立体构型严重地影响生物活性,而且Sp比Rp稳定的多。03 碱基的修饰
碱基的修饰在核酸药开发非常常见,比如假尿苷、2-硫代尿苷、5-甲基胞苷等。这些修饰能降低免疫系统的识别,避免被核酸酶水解。考虑到安全性的问题,制药公司主要集中在5mC和6mA,因为这两种修饰在生物体内本来就存在。
在核酸药物实际开发过程中,通常会同时用到2’OMe,2’F或者PS等修饰。这些修饰的组合产生的依据来源于小核酸(siRNA)的活性,选择性和毒副作用。有时候,研究人员也需要在选择上做平衡。
04 递送系统
小核酸(siRNA)进入体内后必须要跨越多重障碍,比如核酸酶的降解、免疫系统识别、病灶组织的富集、高效的细胞摄取以及从内吞小体的释放等,才能取得预定的治疗效果。前面所述的化学修饰可以提升小核酸在体内的稳定性,但是核酸药的递送是另外一个需要解决的难题。
小核酸(siRNA)因为含有多个磷酸酯键而带有大量的负电荷。这样的极性分子很难自行穿过细胞膜,又很容易被肾小球过滤富集在尿液中。因此,小核酸一旦离开血液,就富集在膀胱,几分钟或者半小时内就被排除体外,导致小核酸无法在病灶组织的富集。将小核酸药物用载体(如LNP)包裹或者和特定配体(如GalNac)连接能有效避免肾消除,而且还能靶向性地富集在特定的组织中(图3)。不同的递送系统,如脂质体(LNP)、GalNac-SiRNA复合体和多肽纳米粒子等已经被深入的探索,并得到实际应用。在此,重点介绍一下脂质体和半乳糖胺衍生的配体(GalNAc)。
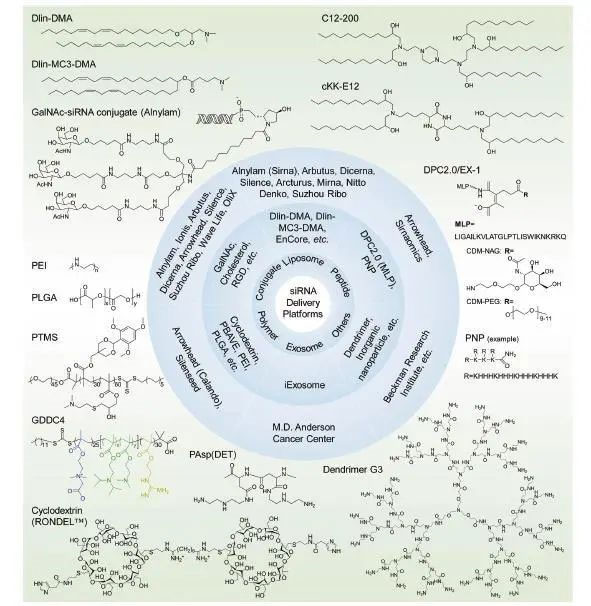
图3 siRNA药物递送系统
4.1 脂质体和脂质体纳米粒子
脂质体(LNPs)最开始是为DNA相关药物而开发的递送载体。后来,脂质体扩展到小核酸(siRNA)递送的应用,因为这些递送载体能包裹小核酸避免其被核酸酶分解和肾脏的快速消除,而且能够将包裹的小核酸靶向性的运送到目标组织和细胞。LNPs-siRNA递送系统一般包含可离子化的脂质体,聚乙二醇和胆固醇等,包埋的复合物通过注射给药后主要富集在肝、脾、肾等部位。
脂质体(LNPs)可分为可离子化的脂质体[Z1] [Z2] ,阳离子的脂质体和电中性的脂质体。可离子化的脂质体在血液循环中不带电荷,但是在较低的pH环境下被质子化,比如在内涵体和溶酶体中。这些分子和载脂蛋白(ApoE3)相互作用,被转移至肝脏。阳离子脂质体在血液循环,内涵体和溶酶体中均带正电荷,主要富集在肝脏。与可离子化的脂质体比较,静电诱导的同血浆蛋白非特异性结合和较高的免疫反应使得阳离子脂质体体内效能较低,并且毒性相对较大。这也促使制药企业投入更多经历去开发可离子化的脂质体,以增加效能、降低副作用。Arbutus、Alnylam和MIT都建立了脂质体相关的递送系统(图3),比如:DLin-MC3-DMA、DLin-DMA、C12-200等。
过去10年中,科学家们总结出了一些开发脂质体的一些理论。Manoharan等人发现脂质体的pKa是影响递送的关键参数。另外,聚乙二醇-碳14(PEG-C14)比聚乙二醇-碳16(PEG-C16)和聚乙二醇-碳18(PEG-C18)递送效率要高。聚乙二醇的含量在1.5%左右展现出最好的效率。
4.2 半乳糖胺配体(GalNAc)
Alnylam发现GalNAc-siRNA复合物在活性和安全性等方面都展示出更好的治疗效果。GalNAc可以和脱唾液酸糖蛋白受体(ASGPR)特异性的结合。这个受体在肝脏细胞表面特异性的,大量的表达,而在其他的细胞中却很少表达。ASGPR受体可以将半乳糖衍生的配体转移到细胞内。构效关系表明,三或四齿配体的结合力远远大于单齿和双齿配体。因此,将三或四齿配体与小核酸共价连接,就可以实现小核酸的递送。
有证据表明,皮下注射比静脉注射效果更好。因为,GalNAc-siRNA复合物通过静脉注射进去血液后,很快会通过肾脏排泄。另外,GalNAc-siRNA复合物的递送是通过ASGPR介导,这本身就是一个自然的机制,所以更加安全。GalNac-siRNA复合物通过皮下注射后,展现出非常好的药效。更为重要的是,这个复合物展示出了长效的功能,基本可以实现季度或者半年给药一次。除了Alnylam、Arrowhead、Dicerna、Arbutus、Silence、Ionis、Wave Life、Regulus和苏州瑞博等都建立相应的递送技术平台。
总之,小核酸药物领域经过20年的发现,领域内的技术难题,如小核酸的稳定性、递送系统等,取得了很大突破,使得小核酸药物成为治疗各种疾病的新途径。世界范围内,就目前研究进展来看,小核酸药物的应用主要集中肝脏发生的疾病。随着科研的深入,新的递送系统,有望将小核酸药物递送至其他器官,届时将会会扩大小核酸的治疗领域。可以预见,小核酸药物将会成为未来的疾病治疗主要的方式之一。
基于在小分子药物开发和DELT领域的技术优势,成都先导药物开发股份有限公司(以下简称“成都先导”)在核苷核酸化学领域也积累了丰富经验, 能够完成各种高难度挑战性修饰(工艺路线可长达40步),目前合成核苷分子类型累计超500种,同时部分产品如核酸合成常用单体、修饰单体、脂质体(MC3-DMA)等备有大量库存,能快速满足客户不同需求。基于在核苷合成修饰能力与经验,成都先导也搭建了核酸分子合成平台,不仅提供常规建库DEL引物,同时也能合成高质量的DNA/RNA产品。该平台主要聚焦于核酸的化学修饰及偶联技术开发,包括核苷修饰(核糖、碱基)、端位修饰(氨基、磷酸化、胆固醇、荧光基团等)、功能分子偶联(多肽、多糖与脂类等)、骨架修饰(甲基化、硫代)等,旨在为合作伙伴提供高质量的个性化定制核酸产品。
岛津企业管理(中国)有限公司作为成都先导药物开发股份有限公司全方位的战略合作伙伴,目前已与成都先导在核酸化学合成的质量及表征方面开展了系列合作,我们期待在此基础上,不断巩固和完善双方的合作成果,让此技术服务于更广阔的客户。

核酸类及小分子化合物制备纯化(LH-40)

核酸类化合物表征(LCMS-2020)

手性化合物拆分(Nexera UC)
参考资料:
1. 《权威解读!一文让你详细了解新冠病毒疫苗及其研发现状!》,2020年7月12日,https://mp.weixin.qq.com/s/iA933ngKpm_Iup8jcxMqKg
2. 《核酸药物深度盘点》,2020年5月22日,https://mp.weixin.qq.com/s/vv17iojAN-eMLX_-38o34Q
3. 本文编译自:Hu B, Zhong LP, Weng YH, Peng L, Huang YY, Zhao YX, Liang XJ. Therapeutic siRNA: state of the art. Signal Transduction and Targeted Therapy, 2020, 5: 101-124.

