岛津红外光谱丨带您探索蛋白质二级结构的奥秘
导读
蛋白质是一类与生命相关的生物大分子,其许多特定的生理或药理活性在很大程度上和构象有关,蛋白质二级结构的基本类型有 α-螺旋、β-折叠、β-转角、Ω环和无规卷曲。蛋白质的结构与功能的关系对于生物学、医学和药学都具有非常重要的意义,蛋白质构象改变可引起疾病,如朊蛋白的二级结构α-螺旋变为β-折叠就会导致疯牛病。蛋白质中各种类型的二级结构并不是均匀地分布在蛋白质中,不同蛋白质中β-折叠和β-转角的数量也有很大的变化。二级结构是通过骨架上的羰基和酰胺基团之间形成的氢键维持的,氢键是稳定二级结构的主要作用力。
蛋白质结构常见分析方法比较

注:CDE(CENTER FOR DRUG EVALUATION)即药品审评中心
下面小编带您一起了解,红外光谱法分析牛血清白蛋白二级结构的案例。
岛津方案
分析利器

岛津傅立叶变换红外光谱仪IRXross

MicromATR测定装置
特点介绍

分析流程图

方法学结果
牛血清白蛋白红外测试
与二级结构相关的红外吸收在多个吸收重叠的状态下,在1650 cm-1附近作为一个宽谱峰出现,该谱峰被称为“酰胺Ⅰ带”,是源于肽键C=O基的伸缩振动,对于研究二级结构很有价值。使用红外和ATR附件分别对牛血清白蛋白和水进行红外测试,并通过软件计算得到差谱,见图1。
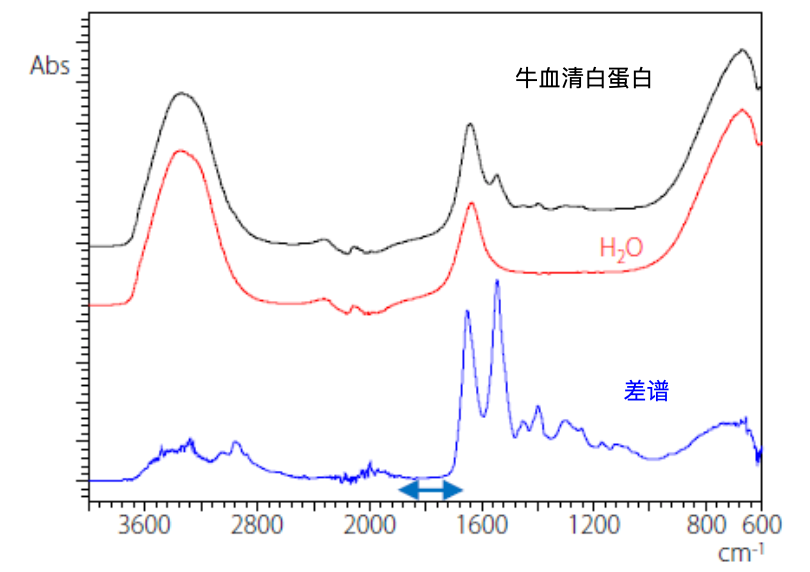
图1. 牛血清白蛋白、H2O的红外光谱及差谱谱图
二阶导数光谱
在进行分峰时,需要提前设置吸收带的峰形、峰个数等的初始值,使用二阶导数确定峰的个数。用图2所示的二阶导数光谱中计算了1700~1480 cm-1范围内峰的波数和个数。
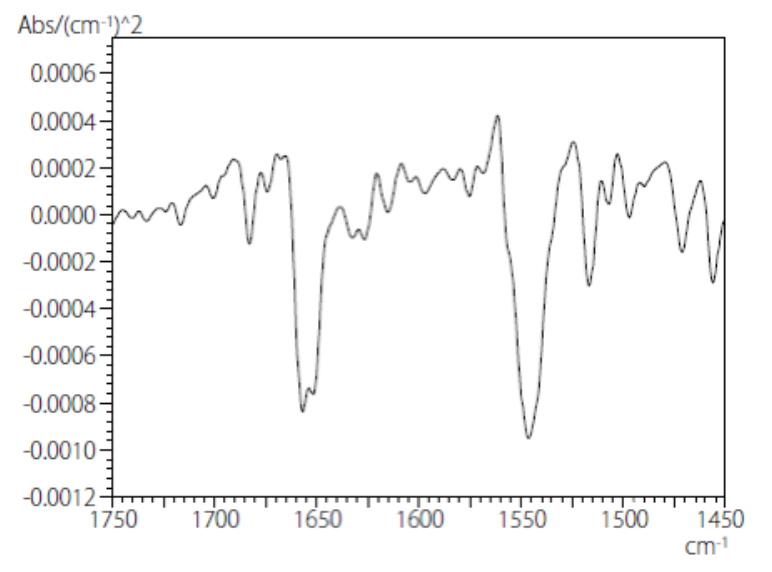
图 2. 牛血清白蛋白的二阶导数光谱
分峰拟合
基于二阶导数光谱信息,对图1的差谱在1760~1480 cm-1范围内进行分峰拟合,图3显示了曲线分峰之前的红外光谱、通过曲线拟合确定的各个峰以及从各个峰合成的光谱。如果曲线拟合精度良好,则测量光谱和合成光谱应匹配良好。
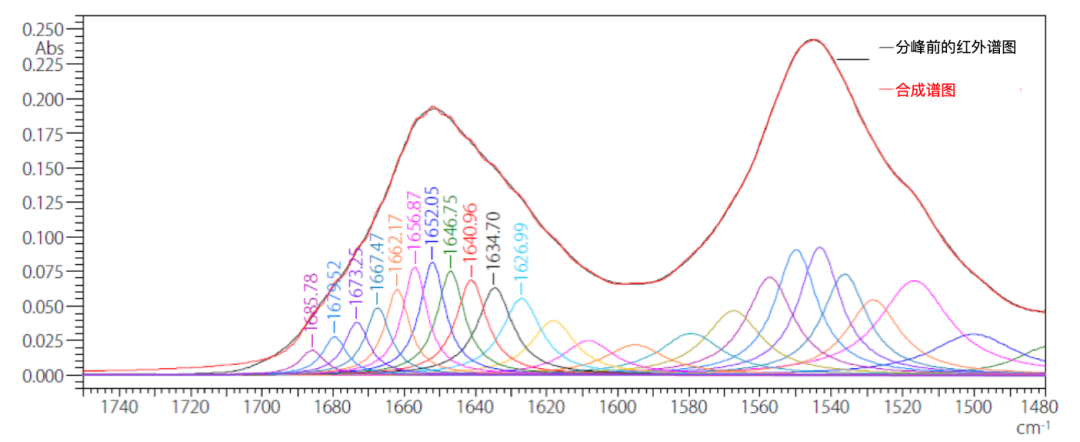
图3. 通过分峰得到的各峰值和合成光谱
蛋白质的二级结构分析
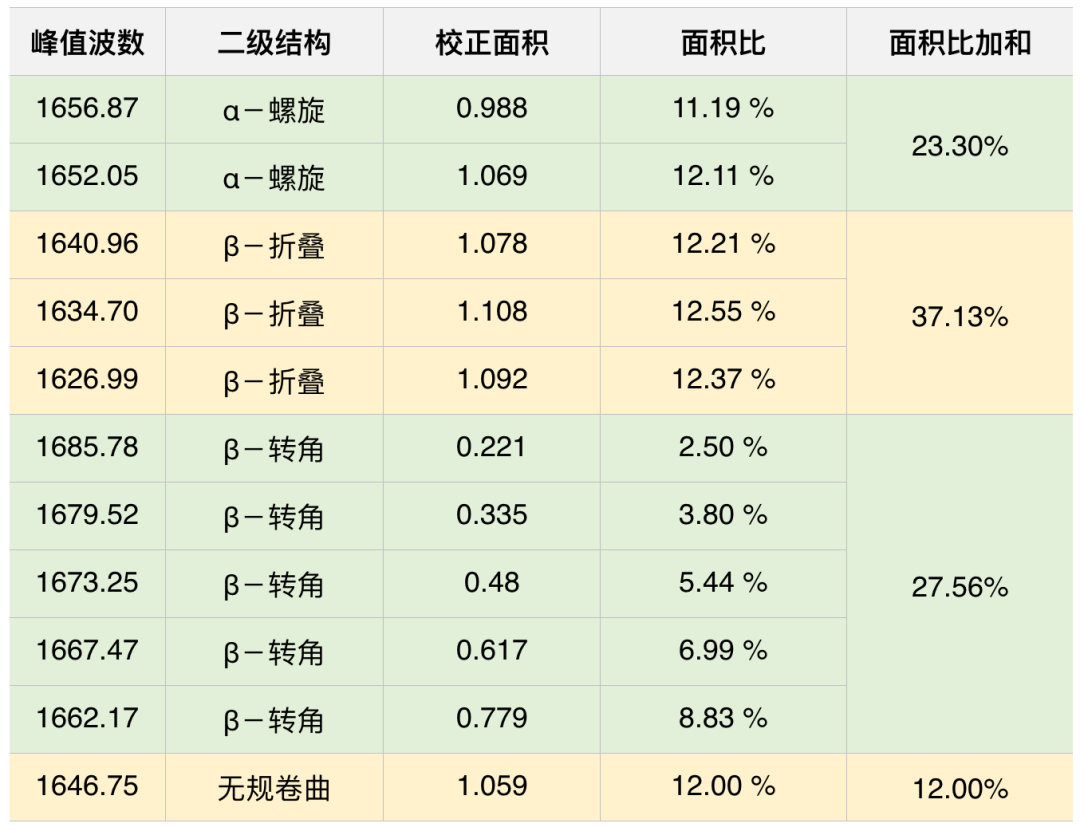
对构成酰胺Ⅰ带的1700~1600 cm-1附近的波形进行峰值检测,求得谱峰波数和校正面积。其结果如表1所示。对各峰进行二级结构分配,求得二级结构的比例。通过上述操作,求得α-螺旋、β-折叠、β-转角、无规卷曲的比例分别为23.30%、37.13%、27.56%和12.00%。
表1. 分峰峰值分析
结语
每种氨基酸残基都是发色团, 它适用于不同状态、不同浓度及不同环境中蛋白质和多肽的测定,红外光谱各种实验技术的发展, 为研究蛋白质及多肽的结构与功能的关系提供了有力手段。红外光谱法对牛血清白蛋白进行分析,通过酰胺Ⅰ带进行分峰,可以方便解析水溶液中蛋白质的二级结构,对蛋白质结构研究提供依据。
本文源于:S. Iwasaki, R. Fuji(岛津制作所全球应用技术开发中心),使用FTIR分峰法对牛血清白蛋白进行二级结构分析。

